
專屬客服號

微信訂閱號
全面提升數據價值
賦能業務提質增效
摘要:處于低水平重復的仿制藥企業,從歷次GMP的升級到現在的全面篩選洗牌,一直都是在“痛苦中煎熬”。而立足于創新的高端仿制藥企業,憑借技術管理的優勢,在這場政策風暴中安然度過并取得市場領先地位。
過去市場被批準上市的仿制藥沒有與原研藥一致性評價的強制性要求,大部分仿制藥與原研藥存有差距,因此國家出臺一系列一致性評價政策,要求已批準上市的仿制藥需要按照原研藥的療效和質量一致的原則,分批次的進行一致性評價,達到與原研藥療效質量一致的水平,從而提高我國仿制藥的質量和整體行業的發展水平,以保證人們的用藥安全有效。
仿制藥與原研藥存在差距,難以完全達到原研藥的效果
原研藥是指原創性新藥,其上市過程異常復雜,需要經過上萬種化合物的層層篩選和嚴格的臨床試驗等過程,平均需要花費數十億美金和數十年時間進行研發,價格昂貴。而仿制藥不需要進行多年的臨床試驗,只需要與原研藥進行質量對比和生物等效性研究即可獲批上市,與原研藥在制備工藝等方面不可能完全相同,藥效有所差異。
仿制藥的安全和有效性比原研藥差似乎已經是社會的“共識”,進而隱性的阻礙了仿制藥市場的發展。仿制藥與原研藥真正差異,可以從生產和安全兩方面看。
生產,原料的純度、其余成分的添加及制造工藝等。仿制藥藥物原料的純度不夠,在生產、運輸、貯存過程中藥品或者藥物原料中都可能混入雜質或者發生降解,影響藥品中活性成分的含量與穩定性,另外產品的雜質水平則取決于處方工藝,仿制藥雜質水平超過標準值。
安全,大部分仿制藥缺乏長時間試驗檢驗和臨床檢驗,病例有限,難以全面、準確反映實際性能。仿制藥以原研藥為對照進行生物等效性對比研究,80%-125%間可認為兩者具有生物等效性。生物等效并不等同于臨床等效,臨床等效原則需要進一步臨床對比研究獲得可靠數據,相比之下,仿制藥由于相關輔料、物質與制備方法的差異,同時缺乏足夠有力的臨床數據,使其在安全和有效性上難以得到完全保證。
一致性評價政策的開展,扭轉仿制藥市場格局的轉變
早在2012年,國家食藥監就開始對15個試點品種進行一致性評價,2013年發布《仿制藥質量一致性評價工作方案》,接著2015年國務院印發《關于改革藥品醫療器械審評審批制度的意見》將“提高仿制藥質量,加快仿制藥質量一致性評價”作為改革藥品審評審批制度的五大目標之一。2016 年 3 月 5 日,國務院辦公廳發布的《關于開展仿制藥質量和療效一致性評價的意見》,這意味著一致性評價正式強力度的開始。詳情見圖1。
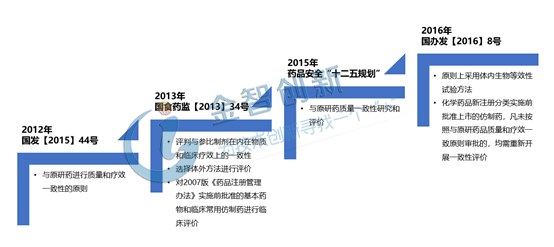
圖1 一致性評價的發展歷程
(資料來源:五度易鏈行研中心)
中研發企業將搶占國內市場份額。一向重視研發投入的巨頭企業,有些之前就已通過歐盟認證,實現產品外銷。對于獲得國際標準的產品,借助一致性評價的壁壘優勢,鎖定國內市場霸主地位更加雄心勃勃,為此企業加大對國內市場的投入,搶占一致性評價壓力下中空出的市場份額,。
合資企業將持續擴大市場優勢。合資進口產品大多享有質量層次單列、中標價格遠遠高于國產仿制藥的價格優勢,在一品兩規中明確占有單獨的名額,一致性評價的強制性推行將繼續擴大其市場優勢,在醫改變藥改的價格沖擊下,使得國產藥更加處于不利和不平等地位。
制藥產業將持續洗牌重塑重組。新版GMP淘汰了一大批企業,一致性評價將繼續淘汰資金、技術和營銷實力弱的企業,各項投入不斷上漲,新企業、小企業、老企業首當其沖,而能最終活下來的產品和企業,對于產品變現也將有更高的要求,專業化收購和包裝產品,專業化運作也將成就一批新貴。
仿制藥優質企業的興起,關鍵在于其對政策、市場和研發的重視
對于一致性評價等政策實施和市場競爭環境的兇險,使得眾多低水平仿制藥企業陷入困境,如何轉型升級走上制勝之路是企業目前應該考慮的。信立泰、恒瑞醫藥、綠葉思科等企業在一致性評價的環境下順勢而為發揮優勢,重視政策、市場和研發并取得可觀的成果,為國產仿藥企業做出表率。
信立泰:把握政策機遇,搶占市場先機。深圳信立泰的泰嘉通過搶仿獲得國內首家仿制藥的先機,并于2000年獲批在國內首仿上市,當時對首仿藥有相應的首仿政策紅利,泰嘉作為二類新藥享有8年的保護期,后續仿制和申報時間超過4年,在這12年的時間內泰嘉作為首仿藥和唯一仿藥的優勢,構建了自身難以撼動的國內市場地位。泰嘉的市場份額由2010年的23.6%提升至2018年的37.2%,如圖2所示。
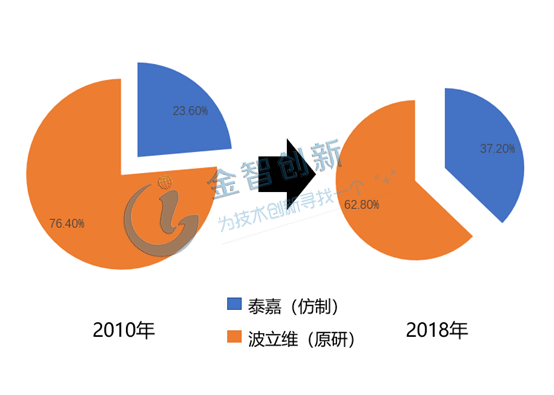
圖2 泰嘉市場份額變化情況
(資料來源:藥學會樣本醫院銷售數據庫)
恒瑞醫藥:借助市場口碑,打造品牌形象。恒瑞醫藥生產的艾素在2002年在國內首仿上市,是恒瑞目前最暢銷的抗腫瘤藥。多年的經營使恒瑞成為國內藥品研發能力頂尖的公司,尤其是近些年在創新藥領域取得了顯著的成就,同時恒瑞在品牌形象和市場宣傳等方面十分重視,因此,由其生產的仿制藥在醫生和患者群體中比較容易獲得較高的認可度和接受度。2010年艾素的市場份額由37.8%上升到2018年的46.02%,詳情請見圖3。
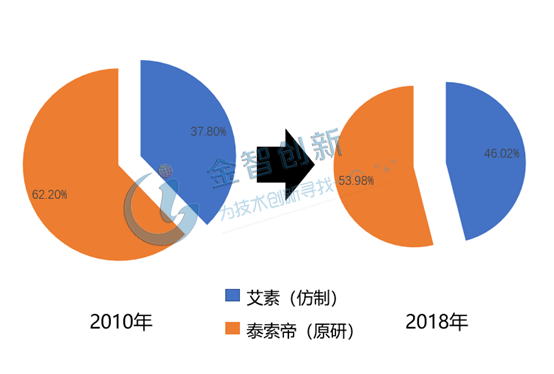
圖3 艾素市場份額變化情況
(資料來源:藥學會樣本醫院銷售數據庫)
南京綠葉思科:重視科技創新,持續升級。2003年南京綠葉思科研制的力樸素,通過制劑創新研發的優勢讓其仿制藥得以升級。力樸素的原研藥是百時美施貴寶的泰素,泰素的注射劑容易引起多種毒副反應。南京綠葉思科在原研藥的基礎上開發了脂質體新劑型,解決了原研藥存在的毒副作用。根據公司市場戰略設定,公司研發過程中先后在美國、印度、俄羅斯、印尼等8個國家提交了發明專利申請并獲權,通過科技創新,力樸素取得市場的認可,市場份額不斷增長。由2010年的35.08%增長至2018年的61.82%,詳情見圖4。
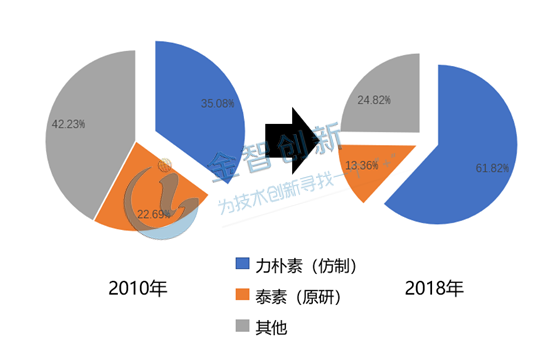
圖4 力樸素市場份額變化情況
(資料來源:藥學會樣本醫院銷售數據庫)
結語
綜上所述,由于過去市場被批準上市的仿制藥沒有與原研藥一致性評價的強制性要求,導致仿制藥與原研藥的質效存有差距,難以完全達到原研藥的效果,隨著一致性評價政策的推進,仿制藥的市場格局發生轉變,使優質企業憑借自身嗅覺和優勢構建了難以撼動的國內市場地位。
本文為我公司原創,歡迎轉載,轉載請標明出處,違者必究!
請完善以下信息,我們的顧問會在1個工作日內與您聯系,為您安排產品定制服務
評論